代表挨拶/領域概要

東京大学・大学院工学系研究科・准教授
再発や転移をともない体内に広がった進行がんに対する、副作用の少ない治療薬開発は、がん治療研究における最大の目標です。近年、分子標的抗体医薬品、免疫チェックポイント阻害剤、アルファ核種放射性治療薬などの、従来の抗がん剤に比べて比較的副作用の少ない治療薬候補が登場してきています。しかしながら、未だコストに対して治療の奏功率が低いため、患者さんごとに最適な治療薬を選定して奏効率を高められるような画期的な診断治療方法が求められています。
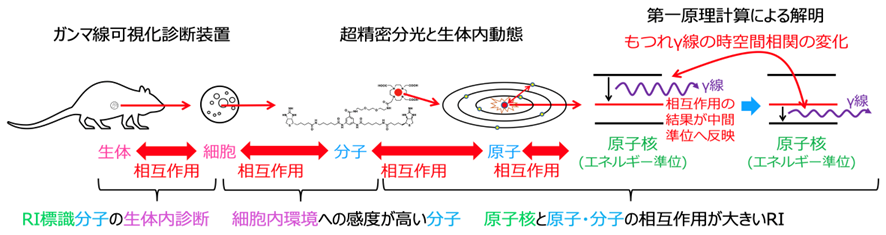
体内のがんの分布を非侵襲的に診断する手法として、PET (Positron Emission Tomography)やSPECT (Single Photon Emission CT)といった核医学イメージング診断手法が広く普及しています。これらの手法では、放射性同位体で標識した薬剤を患者さんに投与してがんに集積させ、放射性同位体から放出される高いエネルギーの光子(γ線)を測定することで、がんの位置を特定することができます。また、ガンマ線に加えてβ線やα線を放出する放射性同位体を用いることで、がんの位置の診断に加えてがんを治療する効果を加えることも可能です。しかしながら、がん周辺の生体内化学的環境の様子を核医学診断手法で調べることはこれまでできていませんでした。
放射性同位体の原子核から放出される2個のもつれ光子対(γ線対)の角度相関は、化学的環境や分子間相互作用に応じてわずかに変化することが知られています。この原理を元に、本研究領域では、世界初の全身分子間相互作用イメージング診断・治療手法を創出することを目指します。もつれ光子対放出原子核―分子間相互作用プローブを利用した革新的な「光子対診断治療学」の創生により、異常な細胞の位置と化学的環境を非侵襲的に診断することが可能となり、悪性腫瘍・アルツハイマー病等の治療高度化や、患者さんごとに治療方法を最適化した個別化医療の実現につながると期待されます。

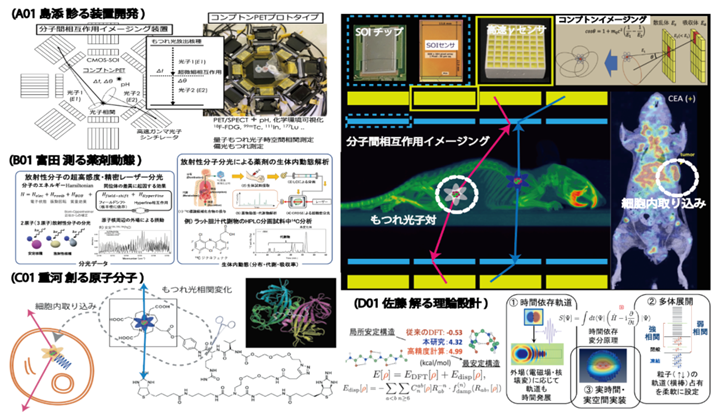
生体は細胞、細胞は分子、分子は原子、原子は原子核と電子から構成されています。人の個体サイズ(約1 m)に対して、原子核は15桁(10の15乗)程度も小さいため、生体と原子核の空間・エネルギースケールは大きく異なります。「光子対診断治療学」を実現するためには、生体から原子核までまたがる、複数の空間・エネルギースケールの多階層構造を理解し、それらをつなぐ技術を開発する必要があります。そのために、本研究領域では、理学・工学・薬学・医学等の様々な分野から研究者を結集しました。本領域の研究者は、次世代核医学診断装置開発、分子薬剤送達システム、治療・診断核種製造、薬剤治療効果評価、薬剤動態分子分光、原子核・電子・分子第一原理計算など、複数の空間・エネルギースケールの階層学問領域にまたがる専門家であり、相互に協力することで新たな融合領域を形成します。